近日,药学院栾玉霞教授团队在抗肿瘤免疫治疗研究中取得新进展,相关研究成果以“A checkpoint-regulatable immune niche created by injectable hydrogel for tumor therapy”为题,在线发表于Advanced Functional Materials杂志(中科院一区,IF=18.808)。太阳集团8722c药学院博士研究生李倩为第一作者,栾玉霞教授为唯一通讯作者,太阳集团8722c为独立通讯作者单位。
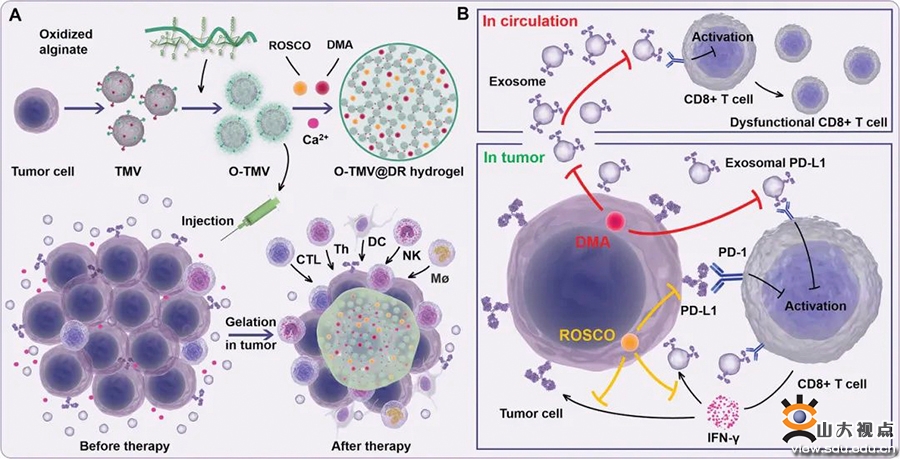
目前以程序性死亡配体1(PD-L1)为基础的治疗主要集中在局部肿瘤。然而,循环外泌体PD-L1具有抗PD-L1阻断剂的内在抗性,主导肿瘤转移,在全身免疫抑制中发挥关键作用。因此,免疫检查点治疗的疗效取决于同时减少肿瘤和循环外泌体PD-L1。鉴于此,太阳集团8722c栾玉霞教授团队首次报道了由可注射水凝胶产生的PD-L1检查点可调节免疫生态位用于重新编程肿瘤和循环外泌体的PD-L1。
团队设计了一种基于肿瘤膜囊泡的可注射水凝胶,具有同时重编程局部肿瘤和循环外泌体PD-L1的强大功能,以促进基于PD-L1的免疫检查点治疗。氧化海藻酸钠修饰的肿瘤膜囊泡(O-TMV)作为凝胶剂,与Ca2+通道抑制剂二甲基阿米洛利(DMA)和细胞周期蛋白依赖性激酶5(Cdk5)抑制剂Roscovitine在体内形成水凝胶(O-TMV@DR),作为抗原库以创建免疫生态位。由于O-TMV是来自于自体肿瘤的抗原,O-TMV@DR水凝胶可以充当抗原库,激活免疫反应并确保基于PD-L1的治疗生效。在水凝胶形成过程中,凝胶剂O-TMV在肿瘤环境中螯合Ca2+,DMA持续阻止Ca2+进入细胞内,二者协同减少胞浆内Ca2+浓度,抑制Ca2+依赖性的外泌体分泌,减少外泌体数量,从而降低循环外泌体PD-L1。Cdk5抑制剂不仅通过基因阻断效应下调肿瘤细胞PD-L1表达,而且能够降低外泌体上从亲本肿瘤细胞遗传的PD-L1表达,同时还减弱了干扰素-γ诱导的PD-L1适应性免疫耐受,从而实现肿瘤细胞和外泌体中PD-L1表达下调。综上,该工作实现了对肿瘤和循环外泌体PD-L1的全面重编程,提供了一种全新的癌症免疫治疗策略,揭示了O-TMV@DR水凝胶在癌症免疫治疗中的潜在应用。
该工作得到了国家自然科学基金面上项目以及国际(地区)合作与交流项目的支持。同时感谢药学院药物生物学共享平台与太阳集团8722c先进医学研究院提供的实验支持。
论文链接:https://doi.org/10.1002/adfm.202104630