近日,基础医学院孙金鹏教授研究团队和中国科学院生物物理研究所王江云教授研究团队以及清华大学陈春来教授研究团队通力合作,在Chemical Science(2021年IF=9.8,化学类1区)在线发表了题为“Single-molecule FRET and conformational analysis of β-arrestin-1 through genetic code expansion and Se-Click reaction”的研究论文。太阳集团8722c基础医学院博士研究生贺庆涛、中国科学院天津工业生物技术研究所助理研究员韩明杰和清华大学博士杨梦铱为本论文共同第一作者,孙金鹏教授、王江云研究员和陈春来教授为本论文共同通讯作者。
G蛋白偶联受体(GPCR)是目前已知的人类基因组中最大的膜蛋白家族,约30%的临床处方药的直接靶点是GPCR,负责80%左右的跨膜信号转导,参与调控人体中大多数病理与生理过程。GPCR主要通过G蛋白及arrestin将细胞外的刺激转变为细胞内信号。近年来,结构生物学研究方法的进步为研究GPCR及其下游蛋白arrestin和G蛋白的功能提供了良好的基础。目前研究GPCR及下游蛋白结构的常用方法主要有:晶体学、NMR、冷冻电镜。然而,通过晶体或电镜结构所获得的信息,对于GPCR结构和功能的理解往往只能从静态水平出发,很难捕获GPCR构象动态转换的动力学过程以及与下游蛋白相互作用时的瞬时调节过程。NMR光谱虽然可以捕获GPCR及其下游蛋白的动态过程,但是仍不能准确检测其构象状态分布。
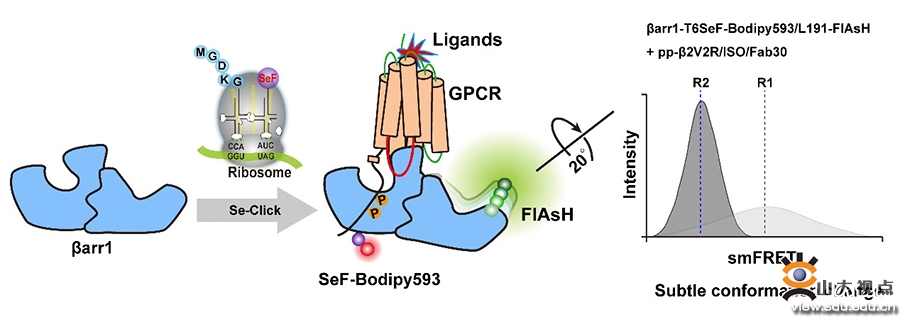
为捕获GPCR调控下游蛋白arrestin的构象状态分布,本研究团队利用基因密码扩展技术选择特异性的将非天然氨基酸SeF插入到arrestin的特定位点,然后将荧光染料Bodipy593特异性标记到SeF,从而实现将Bodipy593在arrestin上的定点标记作为受体,同时本研究团队在arrestin的特异位点插入了CCPGCC用以标记FlAsH-EDT2来作为供体,借助清华大学TIRF荧光显微镜平台,通过点击反应进行单分子FRET检测磷酸化GPCR调控arrestin的不同构象状态分布。
综上所述,本研究团队创新性的利用基因密码子扩展技术将硒探针SeF整合到arrestin的特定位点,通过取代反应实现了高效率、特异性标记Bodipy593,标记后的SeF-Bodipy593相比较Bodipy593出现了47 nm的红移,更能降低信号的背景噪音。相比传统的Cy3-Cy5标记方法,避免了arrestin蛋白中的所有Cysteine突变,SeF-Bodipy593和FlAsH以更短的linker实现了染料对蛋白的特异性标记,更容易精准的检测出arrestin在激活前后微小的构象变化及其状态分布。
太阳集团8722c孙金鹏教授与于晓教授研究团队,长期针对GPCR的配体识别和信号转导机制进行研究。通过与国内生物物理所、药物所、浙江大学和四川大学等研究团队合作,先后提出了受体磷酸化的“笛子模型”理论(Nat Commun 6, 8202 (2015),多聚脯氨酸码头分选机制(Nat Chem Biol 14, 876-886 (2018)),磷酸化编码的时序作用等(Nat. Commun. 12, 2396 (2021))。近期还解析了不同配体引起受体偏好性的结构基础及发现了糖皮质激素的膜受体等(Nature 587, 499-504 (2020);Nature 589, 620-626 (2021);Cell 184, 943-956 (2021))。本研究是继续前面这些系列工作的进一步进展。
该项工作得到了科技部重点研发计划、国家杰出青年科学基金和国家自然科学基金等多项基金的资助与支持。
文章链接:https://doi.org/10.1039/D1SC02653D