近日,基础医学院高成江教授团队在Cell Death & Differentiation杂志(中科院一区,IF:10.717)在线发表以“TRIM26 positively regulates the inflammatory immune response through K11-linked ubiquitination of TAB1”为题的研究成果。太阳集团8722c基础医学院博士研究生赵健和蔡宝珊为论文的共同第一作者,太阳集团8722c高成江教授和助理研究员刘冰玉为该论文的共同通讯作者。太阳集团8722c为第一作者单位和唯一通讯作者单位。本项研究工作得到了易凡和马春红等教授的支持。
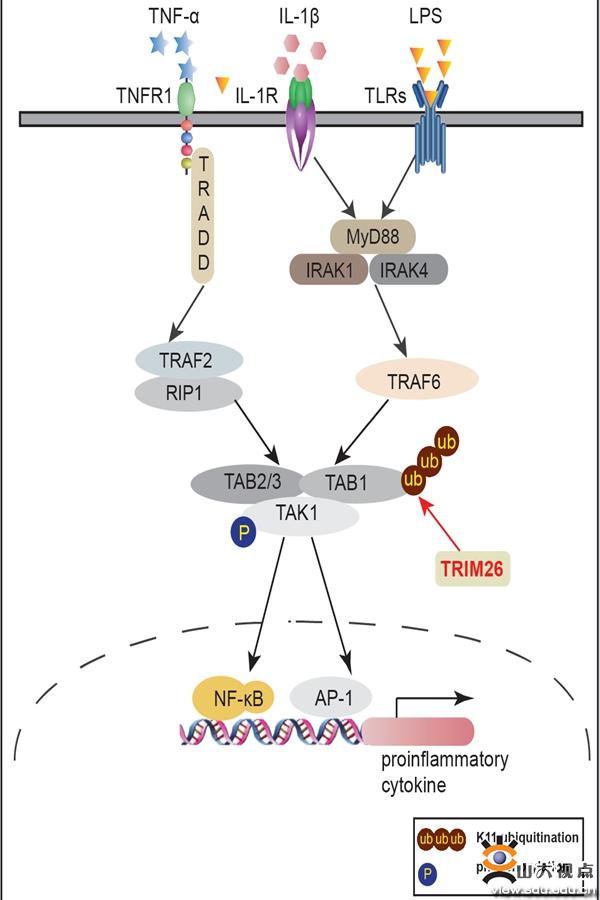
Toll样受体(Toll-like receptors, TLRs)是参与天然免疫的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁。当TLRs被相应配体刺激后,MyD88/TRIF与IRAK1/4等蛋白结合,促进TRAF6及TAK1的激活,并进一步通过NF-κB和MAPK等活化,介导TNFα、IL-6等炎症因子产生,最终在天然免疫抵抗细菌等病原微生物感染过程中发挥着关键作用。TLRs信号的过度激活可导致炎症性疾病,如自身免疫性、内毒素休克、慢性炎症或过敏性疾病。因此,TLRs介导的炎症反应必须得到严格控制。
高成江教授团队已发现泛素连接酶TRIM蛋白家族的TRIM31、TRIM26和TRIM38等成员,在抗病毒天然免疫调控中发挥关键作用(Nat Immunol 2017, 18:214-224; PLoS Pathog 2015, 11:e1004726, J Immunol 2012, 188:5311-5318; J Immunol 2012, 188:2567-2574),但并不清楚TRIM家族成员在炎症反应的功能和作用机制。本研究发现TRIM26在天然免疫TLRs介导的炎症反应中也发挥着关键的调控作用,在小鼠中敲除TRIM26基因可以显著改善LPS介导的内毒素休克。深入的机制研究发现,TRIM26可以与TLRs信号通路下游关键节点蛋白TAB1发生结合,催化其进行K11类型的非经典多聚泛素化修饰,并促进TAK1-TABs复合体的形成及TAK1的激酶活化,最终正向调控TLRs介导的炎症因子生成。该研究揭示了TRIM26介导炎症反应的新机制,并为炎症疾病的治疗提供新的靶点和理论依据。
高成江教授团队长期致力于天然免疫信号转导的调控机制研究,系统探索抗病毒天然免疫信号转导以及炎症反应的调控机制,相关研究成果相继发表在Nature Immunology,Journal of Experimental Medicine,Nature Communication,PLOS Pathology等国际权威杂志上。上述研究得到太阳集团8722c攀登计划创新群体项目、国家自然科学基金重点项目、全国博士后创新人才计划等项目资助。
文章链接:https://www.nature.com/articles/s41418-021-00803-1