近日,基础医学院赵伟教授团队在抗病毒免疫调控研究中取得新进展,相关研究成果以“RNF39 mediates K48-linked ubiquitination of DDX3X and inhibits RLR-dependent antiviral immunity” (“RNF39介导DDX3X K48泛素化修饰、抑制RLR依赖的抗病毒免疫”)为题,在线发表于Science Advances杂志(五年IF=14.094)。该文章太阳集团8722c为独立第一和通讯作者单位,博士研究生王雯雯、博士后贾木天和助理研究员赵春媛为共同第一作者,赵伟教授为通讯作者。
维甲酸诱导基因I样受体(RLRs)是重要的RNA识别受体,识别病毒RNA后,激活接头分子MAVS,促进I型干扰素的表达,启动抗病毒免疫反应。RLR依赖的信号通路在抗病毒感染和维持免疫稳态中发挥着重要的作用;RLRs的异常活化与多种自身免疫紊乱疾病的发生发展密切相关。因此,严密调控RLRs活化,对于保证机体迅速清除入侵病毒、避免自身损伤均非常重要。RNA解旋酶家族成员DDX3X是RNA病毒识别通路中的重要接头分子,通过形成MAVS-DDX3X复合体增强抗RNA病毒固有免疫活化;同时,DDX3X还可识别HIV-1 ssRNA,促进机体清除HIV-1。因此,DDX3X对于机体清除病毒非常重要。该研究发现在病毒感染过程中,DDX3X分子第55、138和162位赖氨酸(K55、K138和K162)可发生K48偶联的泛素化修饰、进而通过蛋白酶体降解;而RNF39是介导这一过程的E3泛素连接酶。病毒感染诱导表达的RNF39通过抑制DDX3X表达,阻断MAVS-DDX3-TRAF3复合体的形成,抑制固有免疫活化,实现病毒的免疫逃逸。
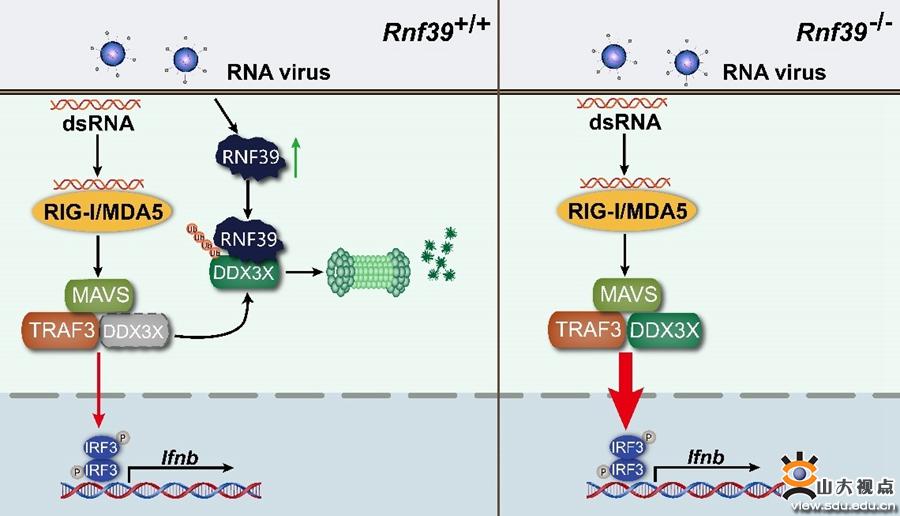
RNF39编码基因位于MHC-I类基因区,且已有GWAS和SNP分析发现RNF39与病毒性疾病的进展密切相关。该研究明确了RNF39在病毒性疾病和固有免疫调控中的具体作用和分子机制;阐明了病毒感染过程中DDX3X泛素化修饰在抗病毒免疫调控中的重要作用;揭示了病毒通过诱导RNF39表达,抑制机体免疫活化、实现免疫逃逸的机制;为病毒性疾病和自身免疫病等的防治提供了新的靶点。
赵伟教授团队长期从事病毒感染与固有免疫研究,揭示病毒感染过程中固有免疫的激活和调控机制;相关研究成果发表在Nat. Immunol.(2020)、Sci.Adv.(2021)、Nat. Commun.(2020,2016, 2014)、J.Exp.Med.(2017)、PNAS.(2016)、Cell.Rep.(2017)等杂志。上述研究得到了国家自然科学基金、英国医学科学院牛顿高级学者等项目的资助。
文章链接:https://advances.sciencemag.org/content/7/10/eabe5877